Le plan de fabrication des protéines dépend donc en premier lieu du gène. Or les séquences des gènes ne sont pas strictement identiques d'un individu à l'autre. De plus, dans le cas des êtres vivants diploïdes, il existe deux exemplaires de chaque gène. Et ces deux exemplaires ne sont pas nécessairement identiques. Un gène existe donc en plusieurs versions d'un individu à l'autre et parfois chez un même individu. Ces différentes versions sont appelées allèles. L'ensemble des allèles d'un individu forme le génotype.
Puisque les gènes existent en plusieurs versions, les protéines vont également exister en différentes versions. Ces différentes versions de protéines vont provoquer des différences d'un individu à l'autre : tel individu aura les yeux bleus mais tel autre aura les yeux noirs, etc. Ces caractéristiques, visibles ou non, propres à chaque individu sont appelées le phénotype. Chez un même individu, un groupe de protéines à séquence similaire et fonction identique est dit isoforme. Les isoformes peuvent être le résultat de l'épissage alternatif d'un même gène, l'expression de plusieurs allèles d'un gène, ou encore la présence de plusieurs gènes homologues dans le génome.
Évolution (Théorie) [modifier]
Au cours de l'évolution, les accumulations de mutations ont fait diverger les gènes entre les espèces. De là provient la diversité des protéines qui leur sont associées. On peut toutefois définir des familles de protéines, elles-mêmes correspondant à des familles de gènes. Ainsi, deux espèces proches ont de fortes chances d'avoir des gènes, et par conséquent des protéines, très similaires. Cette similarité peut se mesurer en comparant la séquence des protéines. On peut ainsi classer un groupe de protéines par homologie, des plus semblables aux moins semblables. Ainsi, la fonction des protéines divergera au fur et à mesure que la similarité diminuera.
L'analyse des séquences et des structures de protéine a permis de constater que beaucoup s'organisaient en domaines, c'est-à-dire en parties acquérant une structure et remplissant une fonction indépendamment du reste de la protéine. Selon la théorie des gènes mosaïques, l'existence de protéines à plusieurs domaines est le résultat de la recombinaison en gène unique de plusieurs gènes originellement individuels.
Dans l'alimentation, les protéines sont désagrégées durant la digestion à partir de l'estomac. C'est là que les protéines sont hydrolysées par des protéases et coupées en polypeptides pour ensuite fournir des acides aminés pour l'organisme, y compris ceux, dits essentiels, que l'organisme n'est pas capable de synthétiser. Le pepsinogène est converti en pepsine quand il arrive au contact avec l'acide chlorhydrique. La pepsine est la seule enzyme protéolytique qui digère le collagène, la principale protéine du tissu conjonctif. La plupart de la digestion des protéines a lieu dans le duodénum.
Presque toutes les protéines sont absorbées quand elles arrivent dans le jéjunum et seulement 1 % des protéines ingérées se retrouvent dans les fèces. Certains acides aminés restent dans les cellules épithéliales et sont utilisés pour la synthèse de nouvelles protéines, y compris certaines protéines intestinales, constamment digérées, recyclées et absorbées par l'intestin grêle.
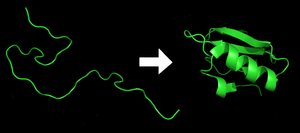
Le repliement de protéine est le processus physique par lequel un polypeptide se replie dans sa structure tridimensionnelle caractéristique dans laquelle il est fonctionnel[1].
Chaque protéine commence sous forme de polypeptide, transcodée depuis une séquence d'ARNm en une chaîne linéaire d'acides aminés. Ce polypeptide ne possède pas à ce moment de structure tridimensionnelle développée (voir côté gauche de la figure). Cependant, chaque acide aminé de la chaîne peut être considéré comme ayant certaines caractéristiques chimiques essentielles. Cela peut être l'hydrophobie, l'hydrophilie, ou la charge électrique, par exemple. Elles interagissent entre elles et ces interactions conduisent , dans la cellule, à une structure tridimensionnelle bien définie, la protéine repliée (à droite sur la figure), connue comme l'état natif. La structure tridimensionnelle résultante est déterminée par la séquence des acides aminés[2],[3] Le mécanisme du repliement de protéines n'est pas encore complètement compris, en particulier l'ordre dans lequel les différentes parties se replient. Le problème est ardu car, par exemple, certaines parties déjà repliées aident au repliement d'autres parties, ce qui le rend le problème non linéaire.
La détermination expérimentale de la structure tridimensionnelle d'une protéine est souvent très difficile et coûteuse. Cependant, la séquence de cette protéine est connue, en particulier depuis le séquençage complet de génomes et la détection automatiques de séquences codantes. En conséquence, les scientifiques ont essayé d'utiliser plusieurs techniques biophysiques pour replier « manuellement » une protéine, c'est-à-dire de prédire la structure d'une protéine complète à partir de sa séquence. Si cette méthode a apporté des résultats intéressants avec de courtes protéines, l'état actuel de la science achoppe complètement à prédire la structure tridimensionelle des protéines intégrales de membranes. D'autres protéines échappent à cette analyse, par exemple les protéines possédant de nombreux ponts disulfures ou encore des protéines synthétisées sous forme de pré-protéine, c'est-à-dire sous forme de protéine précurseur clivée par des protéases spécifiques pour acquérir leur maturité. C'est le cas par exemple de l'insuline.
La structure tridimensionnelle correcte, ou native, est essentielle pour que la protéine puisse assurer sa fonction au sein de la cellule[4]. L'échec du repliement dans la forme attendue produit des
protéines inactives avec des propriétés différentes (par exemple, le prion). De nombreuses maladies neurodégénératives ou autres sont considérées comme résultant d'une accumulation de protéines « mal repliées »[5].
Ce qu'on connait sur le processus [modifier]
La séquence d'acides aminés (ou structure primaire) d'une protéine la prédispose à adopter sa conformation native (ou une de ses conformations natives). Elle se repliera spontanément pendant ou après sa synthèse. Alors que ces macromolécules peuvent être considérées comme se « repliant elles-mêmes », le mécanisme dépend également des caractéristiques du cytosol, comme la nature du solvant primaire (eau ou lipide), la concentration de sels, la température, et des protéines chaperonnes.
La plupart des protéines repliées possèdent un cœur hydrophobe dans lequel l'ensemble des chaines latérales hydrophobes stabilisent l'état replié, et des chaînes latérales polaires ou chargées sur leur surface exposée au solvant par lesquelles elles interagissent avec les molécules d'eau environnantes. Il est généralement admis que la minimisation du nombre de chaînes latérales hydrophobes exposées à l'eau est la principale force motrice du processus de repliement[6], bien qu'une théorie récemment proposée mette l'accent sur les contributions apportées par la liaison hydrogène[7].
Le processus de repliement in vivo débute parfois lors de la traduction, c'est-à-dire que la terminaison N de la protéine commence à se replier alors que la portion terminale C de la protéine est toujours en cours de synthèse par le ribosome. Les protéines spécialisées appelées chaperonnes aident au repliement des autres protéines[8]